Evidencia neuroanatómica del transporte del virus de la rabia por la vía propioespinal de la médula espinal de ratones
Resumen
Introducción. Es escasa la información sobre los detalles neuroanatómicos del transporte del virus de la rabia en su ascenso por la médula espinal.
Objetivos. Identificar la ruta neuroanatómica de diseminación del virus de la rabia en cada uno de los niveles de la médula espinal de ratón, después de ser inoculado por vía intramuscular.
Materiales y métodos. Se inocularon ratones en los músculos isquiotibiales, con virus de la rabia. A partir de las 24 horas después de la inoculación, cada ocho horas se sacrificaron cinco animales por perfusión con paraformaldehído, se les extrajo la médula espinal y se hicieron cortes transversales en los niveles lumbosacro, torácico y cervical. Estos se procesaron mediante inmunohistoquímica para detectar antígenos virales.
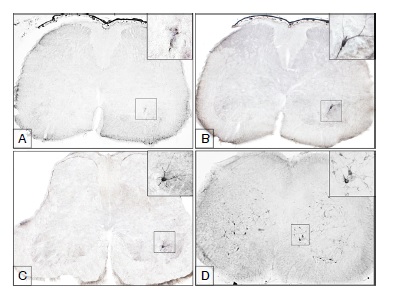
Resultados. Los primeros antígenos de la rabia se observaron como partículas agregadas, en la médula espinal lumbar, a las 24 horas después de la inoculación, dentro del asta ventral ipsilateral a la extremidad inoculada. A las 32 horas después de la inoculación, se hicieron visibles las primeras motoneuronas inmunorreactivas al virus. A las 40 horas después de la inoculación, se revelaron las primeras neuronas inmunorreactivas en la médula torácica, localizadas en la lámina 8 y, a las 48 horas después de la inoculación en la médula cervical, también en la lámina 8. A las 56 horas después de la inoculación, el virus se había diseminado por toda la médula espinal pero los animales aún no revelaban signos de la enfermedad.
Conclusión. En el modelo de ratón aquí utilizado, el virus de la rabia ingresó a la médula espinal por las motoneuronas y, probablemente, utilizó la vía propioespinal descendente para su transporte axonal retrógrado hasta el encéfalo.
Descargas
Referencias bibliográficas
Murphy FA. Rabies pathogenesis. Brief review. Arch Virol. 1977;54:279-97. https://doi.org/10.1007/BF01314774
Jackson AC, Zhen F. Pathogenesis. En: Jackson AC, editor. Rabies. Tercera edición. San Diego: Academic Press; 2013. p. 299-349.
Kristensson K. Retrograde transport of macromolecules in axons. Annu Rev Pharmacol Toxicol. 1978;18:97-110. https://doi.org/10.1146/annurev.pa.18.040178.000525
Tsiang H. Evidence for an intraaxonal transport of fixed and street rabies virus. J Neuropathol Exp Neurol. 1979;38:286-99. https://doi.org/10.1097/00005072-197905000-00008
Watson HD, Tignor GH, Smith AL. Entry of rabies virus into peripheral nerves mice. J Gen Virol. 1981;56:371-82. https://doi.org/10.1099/0022-1317-56-2-371
Gillet JP, Derer P, Tsiang H. Axonal transport of rabies virus in the central nervous system of the rat. J Neuropathol Exp Neurol. 1986;45:619-34.
Ugolini G. Rabies virus as a transneural tracer of neural connections. Adv Virus Res. 2011;79:165-202. https://doi.org/10.1016/B978-0-12-387040-7.00010-X
World Health Organization. WHO Expert consultation on rabies. En: Technical Report Series No. 982. Geneva: WHO Press; 2013. p. 1-139.
Tsiang H, Lycke E, Ceccaldi PE, Ermine A, Hirardot X. The anterograde transport of rabies virus in rat sensory dorsal root ganglia neurons. J Gen Virol. 1989;70:2075-85. https://doi.org/10.1099/0022-1317-70-8-2075
Castellanos J, Hurtado H, Arias J, Velandia A. Rabies virus infection of cultured adult mouse dorsal root ganglion neurons. Mem Inst Oswaldo Cruz. 1996;91:621-5. https://doi.org/10.1590/S0074-02761996000500014
Velandia-Romero ML, Castellanos JE, Martínez-Gutiérrez M. In vivo differential susceptibility of sensory neurons to rabies virus infection. J Neurovirol. 2013;13:367-75. https://doi.org/10.1007/s13365-013-0179-5
Coulon P, Derbin C, Kucera P, Lafay F, Prehaud C, Flamand A. Invasion of the peripheral nervous systems of adult mice by the CVS strain of rabies virus and its avirulent derivative AvO1. J Virol. 1989;63:3550-4.
Zampieri N, Jessell TM, Murray AJ. Mapping sensory circuits by anterograde trans-synaptic transfer of recombinant rabies virus. Neuron. 2014;81:766-78. https://doi.org/10.1016/j.neuron.2013.12.033
Haberl MG, Viana da Silva S, Guest JM, Ginger M, Ghanem A, Mulle C, et al. An anterograde rabies virus vector for high-resolution large-scale reconstruction of 3D neuron morphology. Brain Struct Funct. 2015;220:1369-79. https://doi.org/10.1007/s00429-014-0730-z
Heise C, Kayalioglu G. Cytoarchitecture of the spinal cord. En: Watson C, Paxinos G, Kayalioglu G, editores. The spinal cord. San Diego: Academic Press; 2009. p. 64-93.
Habel K. Habel Test For Potency. En: Meslin FX, Kaplan MKH, editores. Laboratory techniques in rabies. Cuarta edición. Geneva: WHO Press; 1996. p. 369-73.
Lamprea NP, Ortega LM, Santamaría G, Sarmiento L, Torres-Fernández O. Elaboración y evaluación de un antisuero para la detección inmunohistoquímica del virus de la rabia en tejido cerebral fijado en aldehídos. Biomédica. 2010;30:146-51. https://doi.org/10.7705/biomedica.v30i1.162
Watson C, Paxinos G, Kayalioglu G, Heise Claire. Atlas of the mouse spinal cord. En: Watson C, Paxinos G, Kayalioglu G, editores. The espinal cord. San Diego: Academic Press;2009. p. 308-79.
Sengul G. Watson C. Spinal Cord: En: Watson C, Paxinos G, Puelles L. The mouse nervous system. San Diego: Academic Press; 2012. p. 424-58.
McHanwell S, Biscoe TJ. The localization of motoneurons supplying the hindlimb muscles of the mouse. Phil Trans R Soc Lond B. 1981;293:477-508. https://doi.org/10.1098/rstb.1981.0082
McHanwell S, Watson C. Localization of motoneurons in the spinal cord. En: Watson C, Paxinos G, Kayalioglu G, editores. The spinal cord. San Diego: Academic Press; 2009. p. 92-114.
Conta AC, Stelzner DJ. The propiospinal system. En: Watson C, Paxinos G, Kayalioglu G, editores. The spinal cord. San Diego: Academic Press; 2009. p. 178-90.
Ni Y, Nawabi H, Liu X, Yang L, Miyamichi K, Tedeschi A, et al. Characterization of long descending premotor propiospinal neurons in the spinal cord. J Neurosci. 2014;34:9404-17. https://doi.org/10.1523/JNEUROSCI.1771-14.2014
Juntrakul S, Ruangvejvorachai P, Shuangshoti S, Wacharapluesadee S, Hemachudha T. Mechanisms of scape phenomenon of spinal cord and brainstem in human rabies. BMC Infect Dis. 2005;5:104. https://doi.org/10.1186/1471-2334-5-104
Kojima D, Park CH, Satoh Y, Inoue S, Noguchi A, Oyamada T. Pathology of the spinal cord of C57BL/6J mice infected with rabies virus (CVS-11) strain. J Med Vet Sci. 2009;71:319-24. https://doi.org/10.1292/jvms.71.319
Bassuino DM, Konradt G, Cruz RA, Silva GS, Gomes DC, Pavarini SP, et al. Characterization of spinal cord lesions in cattle and horses with rabies: the importance of correct sampling. J Vet Diagn Invest. 2016;28:455-60. https://doi.org/10.1177/1040638716647992
Dean DJ, Evans WM, McClure RC. Pathogenesis of rabies. Bull World Health Organ. 1963;29:803-11.
Baer GM, Shanthaveerappa TR, Bourne GH. Studies on the pathogenesis of fixed rabies virus in rats. Bull World Health Organ. 1965;33:783-94.
Watson HD, Tignor GH, Smith AL. Entry of rabies virus into the peripheral nerves of mice. J Gen Virol. 1981;56:371-82. https://doi.org/10.1099/0022-1317-56-2-371
Tsiang H. Pathophysiology of rabies virus infection of the nervous system. Adv Virus Res.1993;42:375-412.
Ugolini G. Use of rabies virus as transneuronal tracer of neuronal connections: Implications for the understanding of rabies pathogenesis. Dev Biol (Basel). 2008;131:493-506.
Monroy-Gómez J, Torres-Fernández O. Distribución de calbindina y parvoalbúmina y efecto del virus de la rabia sobre su expresión en la médula espinal de ratones. Biomédica. 2013;33:564-73. https://doi.org/10.7705/biomedica.v33i4.1552
Lamprea N, Torres-Fernández O. Evaluación inmunohistoquímica de la expresión de calbindina en el cerebro de ratones en diferentes tiempos después de la inoculación con el virus de la rabia. Colomb Med. 2008;39(Supl.3):7-13.
Algunos artículos similares:
- Jeison Monroy-Gómez, Orlando Torres-Fernández, Distribución de calbindina y parvoalbúmina y efecto del virus de la rabia sobre su expresión en la médula espinal de ratones , Biomédica: Vol. 33 Núm. 4 (2013)
- Nina Paola Lamprea, Lina María Ortega, Gerardo Santamaría, Ladys Sarmiento, Orlando Torres-Fernández, Elaboración y evaluación de un antisuero para la detección inmunohistoquímica del virus de la rabia en tejido cerebral fijado en aldehídos , Biomédica: Vol. 30 Núm. 1 (2010)
- Myriam L. Velandia, José V. Montoya, Marlén Martínez, Sandra Perdomo, Jaime E. Castellanos, Comparación de tres técnicas de trazado retrógrado para la identificación del origen espinal del nervio ciático en ratón. , Biomédica: Vol. 22 Núm. 4 (2002)
- Edwin Abraham Medina, Adenoma del oído medio , Biomédica: Vol. 29 Núm. 3 (2009)
- Andrés Páez, Gloria Rey, Carlos Agudelo, Alvaro Dulce, Edgar Parra, Hernando Díaz-Granados, Damaris Heredia, Luis Polo, Brote de rabia urbana transmitida por perros en el distrito de Santa Marta, Colombia, 2006-2008 , Biomédica: Vol. 29 Núm. 3 (2009)
- Felipe García, Martha C. Domínguez, Miyerlandi Torres, Óscar Tamayo, William Criollo, Milton Quintana, Adalberto Sánchez, Síndrome autoinmune en la paraparesia tropical espástica/ mielopatía asociada a la infección por el virus linfotrópico humano tipo I de la costa pacífica colombiana , Biomédica: Vol. 28 Núm. 4 (2008)
- Aura Caterine Rengifo, Orlando Torres-Fernández, Disminución del número de neuronas que expresan GABA en la corteza cerebral de ratones infectados con rabia , Biomédica: Vol. 27 Núm. 4 (2007)
- Orlando Torres-Fernández, Gloria E. Yepes, Javier E. Gómez, Alteraciones de la morfología dendrítica neuronal en la corteza cerebral de ratones infectados con rabia: un estudio con la técnica de Golgi , Biomédica: Vol. 27 Núm. 4 (2007)
- Nadia Yadira Castañeda, Jacqueline Chaparro-Olaya, Jaime E. Castellanos, Producción y caracterización de un anticuerpo policlonal dirigido contra la fosfoproteína del virus de la rabia , Biomédica: Vol. 27 Núm. 2 (2007)
- Jessika Valderrama, Ingrid García, Germán Figueroa, Edilberto Rico, Juliana Sanabria, Nicolás Rocha, Edgar Parra, Cecilia Saad, Andrés Páez, Brotes de rabia humana transmitida por vampiros en los municipios de Bajo y Alto Baudó, departamento del Chocó, Colombia 2004-2005 , Biomédica: Vol. 26 Núm. 3 (2006)
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |

























