Variabilidad genética de Aedes aegypti en el departamento de Sucre, Colombia, mediante el análisis de la secuencia de nucleótidos del gen mitocondrial ND4
Resumen
Introducción. Aedes aegypti es la especie de mosquito de mayor relevancia en América por transmitir los virus del dengue, del Zika, del chikungunya y de la fiebre amarilla. Tanto factores ecológicos como el control químico, pueden influir en la composición genética de las poblaciones de Ae. aegypti, por lo cual es necesaria su caracterización.
Objetivo. Determinar la variabilidad genética de las poblaciones de Ae. aegypti en cuatro municipios del departamento de Sucre, Colombia.
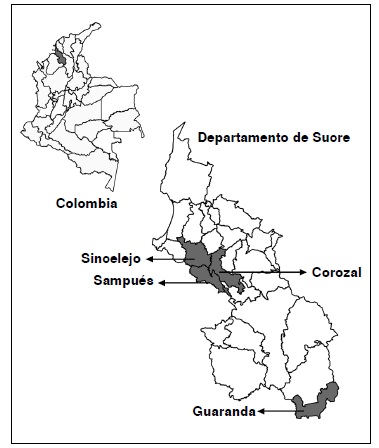
Materiales y métodos. Larvas de Ae. aegypti, recolectadas en los municipios de Sincelejo, Sampués, Corozal y Guaranda del departamento de Sucre, fueron criadas en laboratorio hasta el estado adulto. Como marcador genético, se utilizó un segmento del gen mitocondrial ND4, que codifica para la subunidad 4 de la enzima NADH-deshidrogenasa. El análisis genético incluyó la estimación de parámetros de diversidad de nucleótidos, haplotipos, de estructura genética y de flujo de genes.
Resultados. Se obtuvieron 108 secuencias parciales de 357 nucleótidos y cuatro haplotipos de nucleótidos del gen ND4 de Ae. aegypti. Se encontró una diferenciación genética significativamente alta entre las poblaciones de Sampués y Guaranda mediante el índice de fijación (FST=0,59467), las de Sincelejo y Sampués (FST= 0,25637), y las de Corozal y Guaranda (FST= 0,22237). Se evidenció un gran flujo de genes (Nm=infinito) entre las poblaciones de Sincelejo y Corozal.
Conclusión. Existen diferencias genéticas entre las poblaciones del mosquito Ae. aegypti de los municipios del departamento de Sucre. Se registra la presencia de un nuevo haplotipo del gen mitocondrial ND4 de Ae. aegypti en Colombia, el cual fue detectado en el municipio de Sincelejo.
Descargas
Referencias bibliográficas
Organización Mundial de la Salud. Dengue: guías para diagnóstico, tratamiento, prevención y control. OMS; 2009. Fecha de consulta: 12 de septiembre de 2015. Disponible en: http://apps.who.int/iris/bitstream/10665/44504/1/9789995479213_spa.pdf?ua=1
Aitken TH, Downs WG, Shope RE. Aedes aegypti strain fitness for yellow fever virus transmission. Am J Trop Med Hyg. 1977;26:985-9. https://doi.org/10.4269/ajtmh.1977.26.985
Bennett KE, Olson KE, Muñoz M, Fernández-Salas I, Farfán-Ale JA, Higgs S, et al. Variation in vector competence for dengue 2 virus among 24 collections of Aedes aegypti from Mexico and the United States. Am J Trop Med Hyg. 2002;67:85-92. https://doi.org/10.4269/ajtmh.2002.67.85
World Health Organization. Guidelines for prevention and control of chikungunya fever. World Health Organization. Fecha de consulta: 13 de mayo de 2016. Disponible en: http://www.wpro.who.int/mvp/topics/ntd/Chikungunya_WHO_SEARO.pdf.
Bosio CF, Beaty BJ, Black WC. Quantitative genetics of vector competence for dengue-2 virus in Aedes aegypti. Am J Trop Med Hyg. 1998;59:965-70. https://doi.org/10.4269/ajtmh.1998.59.965
Anderson JR, Rico-Hesse R. Aedes aegypti vectorial capacity is determined by the infecting genotype of dengue virus. Am J Trop Med Hyg. 2006;75:886-92. https://doi.org/10.4269/ajtmh.2006.75.886
Quintero D, Osorio J, Martínez M. Competencia vectorial: consideraciones entomológicas y su influencia sobre la epidemiología del Dengue. Iatreia. 2010;23:146-56.
Lozano S, Fernández I, Muñoz M, García J, Olson K, Beaty B, et al. The neovolcanic axis is a barrier to gene flow among Aedes aegypti populations in mexico that differ in vector competence for dengue 2 virus. PLoS Negl Trop Dis. 2009;3:e468. https://doi.org/10.1371/journal.pntd.0000468
Ravela S, Montenyb N, Velasco D, Verdugob J, Cunya G. A preliminary study of the population genetics of Aedes aegypti (Diptera: Culicidae) from Mexico using microsatellite and AFLP markers. Acta Trop. 2001;78:241-50. https://doi.org/10.1016/S0001-706X(01)00083-3
Yan G, Chadee D, Severson D. Evidence for genetic hitchhiking effect associated with insecticide resistance in Aedes aegypti. Genetics. 1998;148:793-800.
Gorrochotegui-Escalante N, Gómez-Machorro C, Lozano-Fuentes S, Fernández-Salas L, Muñoz M, Farfán-Ale JA, et al. Breeding structure of Aedes aegypti populations in Mexico varies by region. Am J Trop Med Hyg. 2002;66:213-22. https://doi.org/10.4269/ajtmh.2002.66.213
Ocampo C, Wesson D. Population dynamics of Aedes aegypti from a dengue hyperendemic urban setting in Colombia. Am J Trop Med Hyg. 2004;71:506-13. https://doi.org/10.4269/ajtmh.2004.71.506
Julio NB, Chiappero MB, Rossi HJ, Rondan-Dueñas JC, Gardenal CN. Genetic structure of Aedes aegypti in the city of Córdoba (Argentina), a recently reinfested area. Mem Inst Oswaldo Cruz. 2009;104:626-31. http://dx.doi.org/10.1590/S0074-02762009000400016
Sylla M, Bosio C, Urdaneta-Márquez L, Ndiaye M, Black WC. Gene flow, subspecies composition, and dengue virus-2 susceptibility among Aedes aegypti collections in Senegal. PLoS Negl Trop Dis. 2009;3:e408. https://doi.org/10.1371/journal.pntd.0000408
Da Costa-Ribeiro M, Lourenço-de-Oliveira R, Failloux A. Low gene flow of Aedes aegypti between dengue-endemic and dengue-free areas in Southeastern and Southern Brazil. Am J Trop Med Hyg. 2007;77:303-9. https://doi.org/10.4269/ajtmh.2007.77.303
Leiva N, Cáceres O. Variabilidad genética de Aedes aegypti en algunas áreas del Perú usando Single Stranded Conformational Polymorphism (SSCP). Rev Peru Med Exp Salud Pública. 2004;21:158-66.
Da Costa-Ribeiro M, Lourenço-de-Oliveira R, Failloux A. Higher genetic variation estimated by microsatellites compared to isoenzyme markers in Aedes aegypti from Rio de Janeiro. Mem Inst Oswaldo Cruz. 2006;101:917-21. http://dx.doi.org/10.1590/S0074-02762006000800015.
Paupy C, Le Goff G, Brengues C, Guerra M, Revollo J, Barja Z, et al. Genetic structure and phylogeography of Aedes aegypti, the dengue and yellow-fever mosquito vector in Bolivia. Infect Genet Evol. 2012;12(6):1260–9. https://doi.org/10.1016/j.meegid.2012.04.012
Olanratmanee P, Kittayapong P, Chansang C, Hoffmann AA, Weeks AR, Endersby NM. Population genetic structure of Aedes (Stegomyia) aegypti (L.) at a micro-spatial scale in Thailand: Implications for a dengue suppression strategy. PLoS Negl Trop Dis. 2013;7:e1913. https://doi.org/10.1371/journal.pntd.0001913
Costa-da-Silva A, Capurro M, Bracco JE. Genetic lineages in the yellow fever mosquito Aedes (Stegomyia) aegypti (Diptera: Culicidae) from Peru. Mem Inst Oswaldo Cruz. 2005:100:639-44. http://dx.doi.org/10.1590/S0074-02762005000600007
Bosio CF, Harrington LC, Jones JW, Sithiprasasna R, Norris DE, Scott TW. Genetic structure of Aedes aegypti populations in Thailand using Mitochondrial DNA. Am J Trop Med Hyg. 2005;72:434-42. https://doi.org/10.4269/ajtmh.2005.72.434
Bracco J, Capurro M, Lourenço-de-Oliveira R, Mureb-Sallum M. Genetic variability of Aedes aegypti in the Américas using o mitochondrial gene: Evidence of multiple introductions. Mem Inst Oswaldo Cruz. 2007;102:573-80. http://dx.doi.org/10.1590/S0074-02762007005000062
Paduan K, Ribolla P. Mitochondrial DNA polymorphism and heteroplasmy in populations of Aedes aegypti in Brazil. J Med Entomol. 2008;45:59-67. https://doi.org/10.1093/jmedent/45.1.59
Lima R, Scarpassa V. Evidence of two lineages of the dengue vector Aedes aegypti in the Brazilian Amazon, based on mitochondrial DNA ND4 gene sequences. Genet Mol Biol. 2009;32:414-22. http://dx.doi.org/10.1590/S1415-47572009005000036
Caldera S, Jaramillo MC, Cochero S, Pérez-Doria A, Bejarano EE. Diferencias genéticas entre poblaciones de Aedes aegypti de municipios del Norte de Colombia, con baja y alta incidencia de dengue. Biomédica. 2013;33:89-98. http://dx.doi.org/10.7705/biomedica.v33i0.1573
Albrieu G, Gardenal N. Phylogeography of Aedes aegypti in Argentina: long-distance colonization and rapid restoration of fragmented relicts after a continental control campaign. Vector Borne Zoonotic Dis. 2012;12:254-61. https://doi.org/10.1089/vbz.2011.0696
Damal K, Murrell E, Juliano S, Conn J, Loew S. Phylogeography of Aedes aegypti (yellow fever mosquito) in South Mlorida: mtDNA evidence for human-aided dispersal. Am J Trop Med Hyg. 2013;89:482-88. https://doi.org/10.4269/ajtmh.13-0102
Scarpassa V, Bacry T, Cardoso R. Population genetics and phylogeography of Aedes aegypti (Diptera: Culicidae) from Brazil. Am J Trop Med Hyg. 2008;78:895–903. https://doi.org/10.4269/ajtmh.2008.78.895
Cadavid J, Rúa G, Campo O, Bedoya G, Rojas W. Cambios genéticos temporales y microgeográficos de Aedes aegypti en Medellín, Colombia. Biomédica. 2015;35:53-6. https://doi.org/10.7705/biomedica.v35i1.2343
Hoyos-López R, Pardo SR, Castaño JC, Gallego-Gómez JC. Código de barras para la tipificación de culícidos inmaduros de Armenia y Circasia (Quindío, Colombia). Rev Colomb Entomol. 2015;41:218-27. ISSN 0120-0488.
Rueda L. Pictorial keys for the identification of mosquitoes (Diptera: Culicidae) associated with Dengue virus transmission. Zootaxa. 2004;589:1-60. http://dx.doi.org/10.11646/zootaxa.589.1.1
Atencia M, Pérez M, Jaramillo M, Caldera S, Bejarano E. Primer reporte de la mutación F1534C asociada con resistencia cruzada a DDT y piretroides en Aedes aegypti en Colombia. Biomédica. 2016;36:432-7. http://dx.doi.org/10.7705/biomedica.v36i3.2834
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Mol Biol Evol. 2011;28:2731-739. https://doi.org/10.1093/molbev/msr121
Altschul S, Gish W, Miller W, Myers E, Lipman D. Blast BLAST. Basic local alignment search tool. J Mol Biol 1990; 215:403-10. https://doi.org/10.1016/S0022-2836(05)80360-2
Librado P, Rozas J. DnaSP v5: A software for comprehensive analysis of DNA polymorphism data. Bioinformatics. 2009;25:1451-2. https://doi.org/10.1093/bioinformatics/btp187
Tajima F. Evolutionary relationship of DNA sequences in finite populations. Genetics.1983;105:437-60.
Fu Y, Li W. Statistical tests of neutrality mutations. Genetics. 1993;133:693-709.
Fluxus Technology Ltd. NETWORK 4.6.1.1. Steiner (MP) algorithm developed by Tobias Polzin and Siavash Vahdati Daneshmand. Fecha de consulta: 20 de noviembre de
Disponible en: http://www.fluxusengineering.com
Bandelt H, Forster P, Rohl A. Median-joining networks for inferring intraspecific phylogenies. Mol Biol Evol. 1999;16:37-48. https://doi.org/10.1093/oxfordjournals.molbev.a026036
Excoffier L, Lischer H. Arlequin suite ver 3.5: A new series of programs to perform population genetics analyses under Linux and Windows. Mol Ecol Resour. 2010;10:564-67.
Mantel N. The detection of disease clustering and a geneized regression approach. Cancer Res. 1967;27:209-20.
Rousset F. Genetic differentiation and estimation of gene flow from F-statistics under isolation by distance. Genetics. 1997;145:1219-28.
Cavalcanti M. MANTEL v1.19. Centro de Ciências Biológicas, Universidade Santa Úrsula. 2008. Fecha de consulta: 15 de septiembre de 2017. Disponible en: http://life.bio.sunysb.edu/morph/morphmet/mantel32.exe
Jaimes J, Arboleda S, Triana O, Gómez A. Spatiotemporal distribution of Aedes aegypti (Diptera: Culicidae) mitochondrial lineages in cities with distinct dengue incidence rates suggests complex population dynamics of the dengue vector in Colombia. PLoS Negl Trop Dis. 2015;9:e0003553. https://doi.org/10.1371/journal.pntd.0003553
Ministerio de Salud y Protección Social, República de Colombia. Situación actual de Dengue a semana 12 de 2013 periodo de análisis: 2008-2013. Fecha de consulta: 15 de septiembre de 2017. Disponible en: https://www.minsalud.gov.co/Documentos%20y%20Publicaciones/INFORME%20SITUACION%20DE%20DENGUE.pdf
Twerdochlib A, Dalla A, Leite S, Chitolina R, Westphal B, Navarro M. Genetic variability of a population of Aedes aegypti from Paraná, Brazil, using the mitochondrial ND4 gene. Rev Bras Entomol. 2012;56:249-56. http://dx.doi.org/10.1590/S0085-56262012005000030
Brito R, Manfrin M, Sene F. Mitochondrial DNA phylogeography of Brazilian populations of Drosophila buzzatii. Genet Mol Biol. 2002;25:161-71. http://dx.doi.org/10.1590/S1415-47572002000200009
Iturbe U. Adaptaciones y adaptación biológica. Sesbe. 2010;5:5-12.
Wright S. Evolution and the genetics of population, variability within and among natural populations. Chicago: The University of Chicago Press; 1978. p. 4.
Wright S. The genetical structure of populations. Chicago: University of Chicago Press. Annals of Eugenics. 1951;15:323-54.
Nelson MJ. Aedes aegypti: Biología y ecología. Washington: Organización Panamericana de la Salud; 1986. p. 1-50
Algunos artículos similares:
- Sandy Milena Caldera, María Cristina Jaramillo, Suljey Cochero, Alveiro Pérez-Doria, Eduar Elías Bejarano, Diferencias genéticas entre poblaciones de Aedes aegypti de municipios del norte de Colombia, con baja y alta incidencia de dengue , Biomédica: Vol. 33 (2013): Suplemento 1, Fiebres hemorrágicas
- José Joaquín Carvajal, Nildimar Alves Honorio, Silvia Patricia Díaz, Edinso Rafael Ruiz, Jimmy Asprilla, Susanne Ardila, Gabriel Parra-Henao, Detección de Aedes albopictus (Skuse) (Diptera: Culicidae) en el municipio de Istmina, Chocó, Colombia , Biomédica: Vol. 36 Núm. 3 (2016)
- Lucas Alcalá, Juliana Quintero, Catalina González-Uribe, Helena Brochero, Productividad de Aedes aegypti (L.) (Diptera: Culicidae) en viviendas y espacios públicos en una ciudad endémica para dengue en Colombia , Biomédica: Vol. 35 Núm. 2 (2015)
- Tania Camacho, Fernando de la Hoz, Victor Cárdenas, Carmen Sánchez, Laura de Calderón, Ligia Pérez, Antonio Bermúdez, Vigilancia epidemiológica incompleta de la epidemia de dengue-2 en Ibagué, Colombia, 1995-1997 , Biomédica: Vol. 24 Núm. 2 (2004)
- Freddy Ruiz-López, Ana González-Mazo, Andrés Vélez-Mira, Giovan F. Gómez, Luisa Zuleta, Sandra Uribe, Iván Darío Vélez-Bernal, Presencia de Aedes (Stegomyia) aegypti (Linnaeus, 1762) y su infección natural con el virus del dengue en alturas no registradas para Colombia , Biomédica: Vol. 36 Núm. 2 (2016)
- Elizabeth Borrero, Gabriel Carrasquilla, Neal Alexander, Descentralización y reforma: ¿cuál es su impacto sobre la incidencia de malaria en los municipios colombianos? , Biomédica: Vol. 32 (2012): Suplemento 1, Malaria
- Marcela Conde, Lorena I. Orjuela, Cesar Augusto Castellanos, Manuela Herrera-Varela, Susana Licastro, Martha L. Quiñones, Evaluación de la sensibilidad a insecticidas en poblaciones de Aedes aegypti (Diptera: Culicidae) del departamento de Caldas, Colombia, en 2007 y 2011 , Biomédica: Vol. 35 Núm. 1 (2015)
- Érika Patricia Alarcón, Ángela María Segura, Guillermo Rúa-Uribe, Gabriel Parra-Henao, Evaluación de ovitrampas para vigilancia y control de Aedes aegypti en dos centros urbanos del Urabá antioqueño , Biomédica: Vol. 34 Núm. 3 (2014)
- María Elena Cuéllar-Jiménez, Olga Lucía Velásquez-Escobar, Ranulfo González-Obando, Carlos Andrés Morales-Reichmann, Detección de Aedes albopictus (Skuse) (Diptera: Culicidae) en la ciudad de Cali, Valle del Cauca, Colombia , Biomédica: Vol. 27 Núm. 2 (2007)
- Yesika del Carmen Rojas, Helena Brochero, Hallazgo de Aedes aegypti (Linnaeus 1762), en el casco urbano del corregimiento de La Pedrera, Amazonas, Colombia , Biomédica: Vol. 28 Núm. 4 (2008)
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |

























