Detección y caracterización molecular de cepas de Trypanosoma cruzi aisladas de triatominos recolectados por la comunidad en el departamento de Córdoba, Colombia
Resumen
Introducción. Entre el 2011 y el 2016, se reportaron 24 casos de enfermedad de Chagas en Córdoba, según el Sistema Nacional de Vigilancia en Salud Pública (Sivigila), pero la información sobre las unidades discretas de tipificación de Trypanosoma cruzi circulantes y las tasas de infección se desconoce.
Objetivos. Identificar las especies de triatominos con las cuales las personas entran en contacto y que reconocen como vectores de la enfermedad de Chagas, así como establecer la infección por tripanosomas y explorar posibles fuentes de alimentación de los triatominos con la participación de la comunidad.
Materiales y métodos. El muestreo de triatominos se hizo en 12 municipios entre el 2011 y el 2016. T. cruzi se detectó mediante las técnicas de kinetic-polymerase chain reaction (k-PCR) y serial amplification of targets-polymerase chain reaction (SAT-PCR), en tanto que la genotipificación de las cepas se logró mediante la caracterización de secuencias de genes miniexon y de la región intergénica SL-IR (Spliced-Leader Intergenic Region). Se evaluaron, asimismo, las fuentes de alimento.
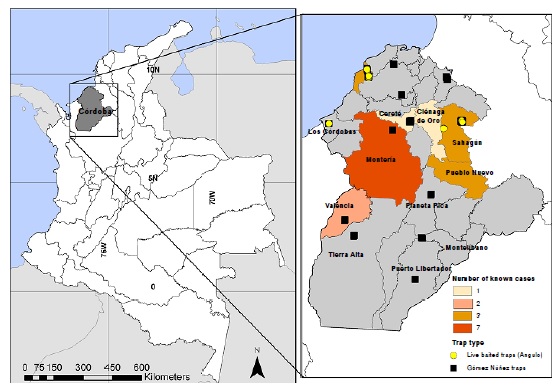
Resultados. La mayoría de los triatominos fue recolectada por miembros de la comunidad y se identificaron tres especies: Rhodnius pallescens, Panstrongylus geniculatus y Eratyrus cuspidatus. La tasa de infección general por T. cruzi fue de 66,6 % y se detectaron las cepas TcIDOM y TcI sylvatic. La participación de la comunidad permitió reportar la presencia de P. geniculatus en dos nuevas localidades, la infección con T. cruzi de P. geniculatus en Córdoba y reportar por primera vez triatominos infectados con T. cruzi en Montería.
Conclusiones. Se demostró la presencia de triatominos infectados con T. cruzi dentro de las viviendas en cinco municipalidades. La cepa circulante dominante fue T. cruzi TcIDOM, asociada con la enfermedad de Chagas y con cardiomiopatías en Colombia. Los resultados resaltan la importancia de vincular a miembros de la comunidad en la vigilancia entomológica.
Descargas
Referencias bibliográficas
Chagas C. Nova tripanozomiaze humana: estudos sobre a morfolojia e o ciclo evolutivo do Schizotrypanum cruzi n. gen., n. sp., ajente etiolojico de nova entidade morbida do homem. Mem Inst Oswaldo Cruz. 1909;1:159-18. https://doi.org/10.1590/S0074-02761909000200008
Teixeira A, Nitz N, Guimaro M, Gomes C, Santos-Buch C. Chagas disease. Postgrad Med J. 2006;82:788-98. https://doi.org/10.1136/pgmj.2006.047357
Jannin J, Villa L. An overview of Chagas disease treatment. Mem Inst Oswaldo Cruz. 2007;102 (Supl. 1):95-7. https://doi.org/10.1590/S0074-02762007005000106
Zingales B, Andrade SG, Briones MR, Campbell DA, Chiari E, Fernandes O, et al. A new consensus for Trypanosoma cruzi intraspecific nomenclature: Second revision meeting recommends TcI to TcVI. Mem Inst Oswaldo Cruz. 2009;104:1051-4. https://doi.org/10.1590/S0074-02762009000700021
Zingales B, Miles M, Campbell D, Tibayrenc M, Macedo A, Teixeira M, et al. The revised Trypanosoma cruzi subspecific nomenclature: Rationale, epidemiological relevance and research applications. Infect Genet Evol. 2012;12:240-53. https://doi.org/10.1016/j.meegid.2011.12.009
Añez N, Crisante G, da Silva F, Rojas A, Carrasco H, Umezawa E, et al. Predominance of lineage I among Trypanosoma cruzi isolates from Venezuelan patients with different clinical profiles of acute Chagas disease. Trop Med Int Health. 2004;9:1319-26. https://doi.org/10.1111/j.1365-3156.2004.01333.x
Guhl F, Ramírez JD. Trypanosoma cruzi I diversity: Towards the need of genetic subdivision? Acta Trop. 2011;119:1-4. https://doi.org/10.1016/j.actatropica.2011.04.002
Guhl F, Aguilera G, Pinto N, Vergara D. Actualización de la distribución geográfica y ecoepidemiología de la fauna de triatominos (Reduviidae: Triatominae) en Colombia. Biomédica. 2007;27(Supl. 1):143-62. https://doi.org/10.7705/biomedica.v27i1.258
Rassi A Jr, Rassi A, Marcondes De Rezende J. American trypanosomiasis (Chagas disease). Infect Dis Clin North Am. 2012;26:275-91. https://doi.org/10.1016/j.idc.2012.03.002
Instituto Nacional de Salud. Enfermedad de Chagas. Fecha de consulta: 30 de enero de 2017. Disponible en: http://simposiovirologia.ins.gov.co/temas-de-interes/Paginas/chagas.aspx
Moncayo A, Silveira AC. Current epidemiological trends for Chagas disease in Latin America and future challenges in epidemiology, surveillance and health policy. Mem Inst Oswaldo Cruz. 2009; 104(supl. 1):17-30. https://doi.org/10.1590/S0074-02762009000900005
Zambrano P. Protocolo de vigilancia en salud pública: Chagas. Fecha de consulta: 14 de noviembre de 2016. Disponible en: http://simposiovirologia.ins.gov.co/lineas-de-accion/Subdireccion-Vigilancia/sivigila/Protocolos%20SIVIGILA/PRO%20Chagas.pdf
Montilla M, Soto H, Parra E, Torres M, Carrillo P, Lugo L, et al. Infestación por triatominos en comunidades indígenas de Valledupar, Colombia. Rev Saúde Pública. 2011;45:773-80. https://doi.org/10.1590/S0034-89102011005000037
Cantillo O, Garcés E, Gómez A, Cortés L, Pereira A, Marcet P, et al. Eco-epidemiological study of an endemic Chagas disease region in northern Colombia reveals the importance of Triatoma maculata (Hemiptera: Reduviidae), dogs and Didelphis marsupialis in Trypanosoma cruzi maintenance. Parasit Vectors. 2015;22:482.
https://doi.org/10.1186/s13071-015-1100-2
Instituto Nacional de Salud. Sistema Nacional de Vigilancia en Salud Pública-Sivigila. Fecha de consulta: 14 de noviembre del 2016. Disponible en: http://www.portalsivigila.ins.gov.co/sivigila/reportes/pages/vigilancia.php
Departamento Administrativo Nacional de Estadística (DANE). Atlas estadístico. Fecha de consulta: 16 de noviembre de 2016. Disponible en: http://www. http://sige.dane.gov.co/atlasestadistico/
Sociedad Geográfica de Colombia. Departamento de Córdoba. Fecha de consulta: 14 de noviembre de 2016. Disponible en: http://www.sogeocol.com.co
Freire EE, Perfetti del Corral M. Pobreza Monetaria 2015: Córdoba. Fecha de consulta: 15 de noviembre de 2016. Disponible en: http://www.dane.gov.co/index.php/estadisticas-por-tema/informacion-regional
Salomon OD. Aspectos de prevención de la enfermedad de Chagas con participación de la comunidad. Fecha de consulta: 14 de noviembre de 2016. Disponible en:
http://www.fac.org.ar/fec/chagas2/llave/md1/md103/salomon.htm
Dumonteil E, Ramírez-Sierra MJ, Ferral J, Euan-García M, Chávez-Núñez L. Usefulness of community participation for the fine temporal monitoring of house infestation by nondomiciliated triatomines. J Parasitol. 2009;95:469-71. https://doi.org/10.1645/GE-1712.1
Gómez-Núñez JC. Desarrollo de un nuevo método para evaluar la infestación intradomiciliaria por Rhodnius prolixus. Acta Cien Ven. 1965;16:26-31.
Angulo V, Esteban L. Nueva trampa para la captura de triatominos en hábitats silvestres y peridomésticos. Biomédica. 2011;31:264-68. https://doi.org/10.7705/biomedica.v31i2.301
Lent H, Wygodzinsky P. Revision of the triatominae (Hemiptera, Reduviidae), and their significance as vectors of Chagas’ disease. Bulletin of the American Museum of Natural History. New York: American Museum of Natural History; 1979. p. 389.
Weirauch C, Bérenger JM, Berniker L, Forero D, Forthman M, Frankenberg S, et al. An illustrated identification key to assassin bug subfamilies and tribes (Hemiptera: Reduviidae). Can J Art Iden. 2014;26:1-115.
Wincker P, Britto C, Borges J, Cardoso MA, Oelemann W, Morel CM. Use of a simplified polymerase chain reaction procedure to detect Trypanosoma cruzi in blood samples from chronic chagasic patients in a rural endemic area. Am J Trop Med. Hyg. 1994;51:771-7. https://doi.org/10.4269/ajtmh.1994.51.771
Virreira M, Torrico F, Truyens C, Alonso-Vega C, Solano M, Carlier Y, et al. Comparison of polymerase chain reaction methods for reliable and easy detection of congenital Trypanosoma cruzi infection. Am J Trop Med Hyg. 2003;68:574-82.
Piron M, Fisa R, Casamitjana N, López-Chejade P, Puig L, Vergés M, et al. Development of a real-time PCR assay for Trypanosoma cruzi detection in blood samples. Acta Trop. 2007;103:195-200. https://doi.org/10.1016/j.actatropica.2007.05.019
Souto RP, Fernandes O, Macedo AM, Campbell DA, Zingales B. DNA markers define two major phylogenetic lineages of Trypanosoma cruzi. Mol Biochem Parasitol. 1996;83:141-52. https://doi.org/10.1016/S0166-6851(96)02755-7
Villa LM, Guhl F, Zabala D, Ramírez JD, Urrea DA, Hernández DC, et al. The identification of two Trypanosoma cruzi I genotypes from domestic and sylvatic transmission cycles in Colombia based on a single polymerase chain reaction amplification of the spliced-leader intergenic region. Mem Inst Oswaldo Cruz. 2013;108:932-5. https://doi.org/10.1590/0074-0276130201
Falla A, Herrera C, Fajardo A, Montilla M, Vallejo GA, Guhl F. Haplotype identification within Trypanosoma cruzi I in Colombian isolates from several reservoirs, vectors and humans. Acta Trop. 2009;110:15-21. https://doi.org/10.1016/j.actatropica.2008.12.003
Sawabe K, Isawa H, Hoshino K, Sasaki T, Roychoudhury S, Higa Y, et al. Host-feeding habits of Culex pipiens and Aedes albopictus (Diptera: Culicidae) collected at the urban and suburban residential areas of Japan. J Med Entomol. 2010;47:442-50.
Rangel JO. Colombia Diversidad Biótica XI Patrones de la estructura y de la riqueza de la vegetación en Colombia. Bogotá: Instituto de Ciencias Naturales, Universidad Nacional; 2011. p. 485.
Zumaya-Estrada FA, Messenger LA, López-Ordóñez T, Lewis MD, Flores-López CA, Martínez-Ibarra AJ, et al. North American import? Charting the origins of an enigmatic Trypanosoma cruzi domestic genotype. Parasit Vectors. 2012;5:226. https://doi.org/10.1186/1756-3305-5-226
Duque MC, Ramírez JD, Rendón LM, Guhl F. Evaluación de la variabilidad genética de aislamientos colombianos de Trypanosoma cruzi mediante marcadores microsatélites. Infectio. 2011;15:227-34. https://doi.org/10.1016/S0123-9392(11)70736-6
Ramírez JD, Duque MC, Montilla M, Cucunubá Z, Guhl F. Natural and emergent Trypanosoma cruzi I genotypes revealed by mitochondrial (Cytb) and nuclear (SSU rDNA) genetic markers. Exp Parasitol. 2012;132:487-94. https://doi.org/10.1016/j.exppara.2012.09.017
León C, Hernández C, Montilla M, Ramírez J. Retrospective distribution of Trypanosoma cruzi I genotypes in Colombia. Mem Inst Oswaldo Cruz. 2015;110:387-93. https://doi.org/10.1590/0074-02760140402
Zeledón R, Rabinovich JE. Chagas’ disease: An ecological appraisal with special emphasis on its insect vectors. Annu Rev Entomol. 1981;26:101-33. https://doi.org/10.1146/annurev.en.26.010181.000533
Christensen HA, de Vásquez AM. Host feeding profiles of Rhodnius pallescens (Hemiptera: Reduviidae) in rural villages of Central Panamá. Am J Trop Med Hyg. 1981;30:278-83. https://doi.org/10.4269/ajtmh.1981.30.278
Algunos artículos similares:
- Víctor Manuel Angulo, Lyda Esteban, Katherine Paola Luna, Attalea butyracea próximas a las viviendas como posible fuente de infestación domiciliaria por Rhodnius prolixus (Hemiptera: Reduviidae) en los Llanos Orientales de Colombia , Biomédica: Vol. 32 Núm. 2 (2012)
- Juan Fernando Ríos, Margarita Arboleda, Alba Nelly Montoya, Erika Patricia Alarcón, Gabriel Jaime Parra-Henao, Probable brote de transmisión oral de enfermedad de Chagas en Turbo, Antioquia , Biomédica: Vol. 31 Núm. 2 (2011)
- Kevin Escandón-Vargas, Carlos A. Muñoz-Zuluaga, Liliana Salazar, Alimentación de Rhodnius prolixus , Biomédica: Vol. 37 Núm. 3 (2017)
- Carmen Vásquez, Sara Robledo, Jaime Calle, Omar Triana, Identificación de nuevos escenarios epidemiológicos para la enfermedad de Chagas en la región momposina, norte de Colombia , Biomédica: Vol. 33 Núm. 4 (2013)
- Camilo Rubio, Ligia Inés Moncada, Marco Andrés Rojas, Alexander García, Comportamiento de Rhodnius robustus Larousse, 1927 (Hemiptera, Reduviidae) durante su alimentación en condiciones de laboratorio , Biomédica: Vol. 33 Núm. 2 (2013)
- Ernesto Pérez-Sánchez, Raúl Montiel-Cruz, Eréndira Romero-Domínguez, Griselda Pascacio-Bermúdez, Arturo Báez-Hernández, Guadalupe Díaz del Castillo-Flores, Fabián Correa-Morales, Gonzalo Vázquez-Prokopec, Pablo Manrique-Saide, Azael Che-Mendoza, Gabriela Meneses-Ruiz , Irma López-Martínez, María Jesús Sánchez, Seroprevalencia de Trypanosoma cruzi en niños de Veracruz, México: línea epidemiológica de base para un modelo de control fundamentado de la transmisión activa de la enfermedad de Chagas , Biomédica: Vol. 44 Núm. 1 (2024)
- Noris García-Jordán, Mariolga Berrizbeitia, Juan Luis Concepción, Elis Aldana, Ana Cáceres, Wilfredo Quiñones, Estudio entomológico de vectores transmisores de la infección por Trypanosoma cruzi en la población rural del estado Sucre, Venezuela , Biomédica: Vol. 35 Núm. 2 (2015)
- Luis Alberto Corté, Henry Alberto Suárez, Triatominos (Reduviidae: Triatominae) en un foco de enfermedad de Chagas en Talaigua Nuevo (Bolívar, Colombia). , Biomédica: Vol. 25 Núm. 4 (2005)
- Víctor Manuel Angulo, Lyda Esteban, Plutarco Urbano, Eduwin Hincapié, Luis Alberto Núñez, Comparación de métodos para la captura de triatominos (Hemiptera: Reduviidae) en palmas Attalea butyracea en los Llanos Orientales de Colombia , Biomédica: Vol. 33 Núm. 4 (2013)
- Omar Cantillo-Barraza, Andrés Gómez-Palacio, Diego Salazar, Ana María Mejía-Jaramillo, Jaime Calle, Omar Triana, Distribución geográfica y ecoepidemiología de la fauna de triatominos (Reduviidae: Triatominae) en la Isla Margarita del departamento de Bolívar, Colombia , Biomédica: Vol. 30 Núm. 3 (2010)
| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |

























